
中国食品药品网 记者 窦洁 报道 11月5日,国家药品审评中心(CDE)官网主页热点栏目中,增加了"临床试验默示许可公示"一栏。业界评价,中国正式对新药临床试验,由过去的审批制改革为默示许可。也就是说,由从前的"点头制"批准正式转入更加高效的"摇头制"批准。
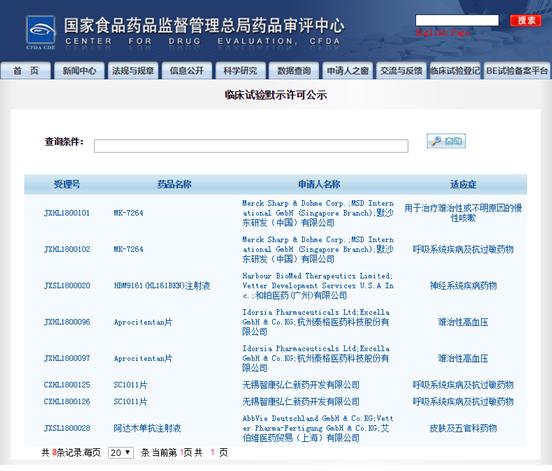
进入栏目可以看到,已有8个受理号获得默许,其中不仅包括来自默沙东研发(中国)有限公司和艾伯维医药贸易(上海)有限公司等跨国制药企业的注册申请,也有来自和铂医药(广州)有限公司、无锡智康弘仁新药开发有限公司等国内制药企业的申请。
加快临床试验管理改革,调整优化药物临床试验审评审批程序,是今年以来药品审评审批制度改革的重点工作之一。2018年7月,国家药品监督管理局发布《关于调整药物临床试验审评审批程序的公告》,已经就药物临床试验审评审批做出调整:在我国申报药物临床试验的,自申请受理并缴费之日起60日内,申请人未收到CDE否定或质疑意见的,可按照提交的方案开展药物临床试验。
此次首批8个临床试验注册获得默示许可公示,意味着我国临床试验管理改革取得了新的进展。业界期待,接下来有更多临床试验在新的政策春风下能够尽快启动,让更多的好药、新药来到患者身边。

