
当前,各国医疗器械主管部门都在加强上市前和上市后的监管。医疗器械的质量管理体系在保证制造商持续满足法规要求、保证医疗器械产品持续安全和有效方面发挥着非常重要的作用。目前,全球主要国家和地区都有关于质量管理体系的法规要求,通常这些法规要求都采用《医疗器械 质量管理体系 用于法规的要求》(ISO13485)或者与ISO13485保持兼容性。每个国家和地区的主管部门都会按照法规的要求对制造商进行审核,但都面临监管资源短缺的问题;同样,医疗器械的制造商,特别是面向全球市场的制造商,都需接受来自不同国家主管部门的体系审核和检查,这给企业带来了一定程度的负担。如果能将各国对体系法规要求的审核或检查合并进行,一次审核满足多国法规要求,不但可以节省各国主管部门的审核资源,同时还可以减轻医疗器械制造商的负担,为医疗行业的发展带来短期和长期的利益。
于是,医疗器械单一审核方案应“需”而生。医疗器械单一审核方案(Medical Device Single Audit Program,缩写为MDSAP)是由国际医疗器械监管机构论坛(IMDRF)发起,旨在由认可的审核机构进行一次审核满足多国法规要求的方案。2012年11月,IMDRF成员中的澳大利亚、巴西、加拿大和美国发布联合声明,正式启动MDSAP,项目的试行阶段从2014年到2016年年底,2015年日本正式加入MDSAP项目,目前共有5个国家参与MDSAP。3年的试运行后,MDSAP于2017年1月正式进入实施阶段。
MDSAP审核机构的认可流程
MDSAP的审核机构由参与国的主管部门按照IMDRF工作文件IMDRF/MDSAP WG/N3中的认可准则进行联合认可。该文件详细规定了审核机构的质量管理体系要求,包括法律、合同、公正性、职责和财务等通用要求;组织架构、人员能力和外包人员的要求;信息、文件记录、保密的要求;审核流程和审核类型的要求;投诉和申诉的要求等。认可的标准和流程借鉴了《合格评定对提供管理体系审核和认证的机构的要求》(ISO/IEC 17021:2011)《欧盟对公告机构要求的草案》《欧盟医疗器械指令认可和监控公告机构框架》《加拿大卫生部对审核机构认定准则草案》《日本厚生省-日本药事法对医疗器械第三方机构合格评定注册准则》《美国食品药品管理局认可审核机构人员评分准则》《国际认可论坛文件-医疗器械质量管理体系应用ISO/IEC 17021的法令文件》等文件要求。
所有5个参与国已认可的第三方机构都可以按照流程申请审核机构资格,一般申请会包括3个步骤:申请阶段、可执行审核阶段和获得资格阶段。每个申请机构都需要接受资料审核以及最少3次现场的见证审核,从而根据审核结果授予资格。截至2018年4月,共有14家第三方机构递交申请,其中有6家机构已经获得认可的资格,它们是英国标准协会(BSI)、德凯(DEKRA)、天祥(Intertek)、通标(SGS)、南德(TUV)和美华(UL)。
MDSAP审核准则和审核周期
MDSAP的审核依据是以ISO13485为基础,加上5个参与国的法规要求。除了常规的质量管理体系之外,还包括上市前和上市后的法规要求。上市前主要是市场批准和注册的流程,以及市场批准和登记的证据,一般不会审核产品上市批准技术文件的详细内容。上市后法规要求包括不良事件的报告、忠告性通知报告和变更报告的要求。需要说明的是,MDSAP认证不会增加新的法规要求,都是执行5个参加国家已有的法规要求。
MDSAP的审核周期与ISO13485一样,也是3年一个循环,包括初次的正式审核,正式审核之后的第一年和第二年为监督审核,第三年为再认证审核。初次的正式审核包括第一阶段和第二阶段,第二阶段会对医疗器械制造商的质量管理体系(QMS)进行完整的审核。与ISO13485不同的是审核时间的计算,1SO13485的审核以企业的员工人数计算人天数,而MDSAP以审核的任务(Task)来计算人天数。申请企业因为需要满足的法规、产品、体系的流程和任务不同,人天数会有差异,通常初次的正式审核需要6~7个人天。
MDSAP审核模式及不符合报告
MDSAP的审核借鉴了美国FDA质量体系检查指南-质量体系检查技巧(QSIT)的审核思路和模式,将质量管理体系分为七大流程,每个流程包括不同的审核任务。其中管理职责流程、测量分析改进流程、设计开发流程和生产服务控制流程是主流程,其他三个流程为支持性流程。
MIDSAP审核模式的设计旨在通过一个更有逻辑、重点突出的审核顺序,以及审核线索的使用和链接,来提供高审核的效率和效果。审核从管理职责开始,后续包括测量分析改进、设计开发、生产服务的提供。另外,上市批准和注册登记、不良事件的报告也包括在审核之内。
MDSAP的审核完成之后,要完成法规审核报告和不符合报告。不符合报告包括不符合的证据,以及不符合对应的每个国家法规的要求,并按照分类准则进行等级判定。
不同于ISO13485将审核发现分为严重不符合和轻微不符合,MDSAP的审核发现按照IMDRF的前身——全球医疗器械协调工作组(GHTF)的指南文件《医疗器械质量管理体系-用于法规目的和信息交流的不符合分级准则GHTF/SG3/N19:2012》分为5个等级(见附表)。
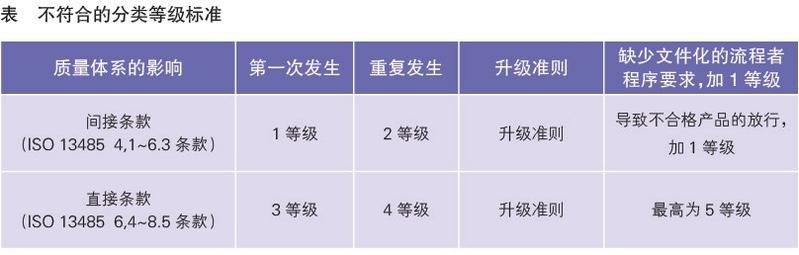
不符合按照直接条款要求或间接条款要求进行不同等级判定,间接条款是指不直接影响产品的质量和安全的ISO13485的4.1~6.3条款,判为第一等级;直接条款要求是指对产品的质量和安全有直接影响的ISO13485的6.4~8.5条款,判为第三等级。如果在过去两年有同样条款的不符合,可认定为重复发生,加一个等级。如果缺少相关文件化的流程或者程序要求,加一个等级。如果导致不合格产品的放行,再加一个等级。不符合的最高等级为5等级。
当有3个或者3个以上的第四等级的不符合,以及任何一个第五等级的不符合,相当于ISO13485的严重不符合。但不同于ISO13485的不符合的关闭,MDSAP对这些“严重”不符合需要通过飞行检查来进行关闭。
MDSAP的执行情况和实施进展
目前5个参与国及世界卫生组织(WHO)对MDSAP审核结果的认可情况如下:
加拿大卫生部(HC)已正式宣布用MDSAP证书取代原有的医疗器械符合性审核程序(CMDCAS)证书,并且决定从2019年1月1日起实施,所有出口到加拿大的Ⅱ类、Ⅲ类和Ⅳ类医疗器械都必须拥有MDSAP证书,才能到HC注册销售产品;美国食品药品管理局(FDA)认可MDSAP审核报告和可使用MDSAP审核报告豁免FDA常规审核,但有因检查和高风险PMA的产品除外;巴西主管部门(ANVISA)对Ⅲ类和Ⅳ类的产品需要执行上市前和上市后的GMP审核,可以将MDSAP的审核结果替代上市前的GMP审核和每两年一次的上市后的常规审核;澳大利亚主管部门(TGA)根据MDSAP的审核结果颁发和维持TGA符合审核的证书,并可能豁免TGA的常规审核;日本厚生劳动省(MHLW)和药品医疗器械管理局(PMDA)认可MDSAP审核报告,可利用MDSAP审核报告豁免现场审核,并允许上市持有人(MAH)用MDSAP的报告作为提交的注册相关文件;WHO可使用MDSAP的审核结果,作为符合国际质量管理体系法规的证据,从而可豁免或者缩减体外诊断产品的资格审查。
根据2017年6月29日发布的《MDSAP试行阶段的最终总结报告》,MDSAP试行阶段的7个概念验证标准目标达成了5个,其中包括大于70%的报告符合规定的要求,大于80%的报告能够支持法规决定,小于5%的审核模型的任务需要修改,小于25%的审核任务的顺序需要修订。该报告还显示审核机构的认可在按照计划推进,参与MDSAP审核的制造商也在不断增加。
对MDSAP的思考和对我国的借鉴
MDSAP虽然取得了很好的效果,能够节省监管资源,提高监管效率,同时减少制造商的负担。但笔者结合自身的审核经验,认为MDSAP尚存在以下问题:
一是MDSAP现包括5国的法规要求,未来还可能有新的国家和地区加入MDSAP的项目中来,这给审核员理解和掌握每个国家的法规要求提出了挑战。特别是各国对不良事件报告、忠告性通知报告以及产品和体系变更的报告部分不尽相同,使审核按法规要求执行的难度加大。
二是MDSAP由第三方审核机构来执行,对第三方机构的监管和审核质量控制是各国主管部门面临的问题。虽然MDSAP制定了详细的审核机构认可流程和准则,但这些机构多是为医疗器械制造商提供ISO13485认证服务的认证机构。ISO13485认证的客户是制造商,但MDSAP认证的客户是主管当局。如何转变审核方式,以满足法规审核的要求,是每个审核机构及审核员需要思考的问题。
三是MDSAP审核的不符合按照等级来进行划分,并且强调了不符合重复发生和导致不合格品交付的严重性,这些都非常好地促进制造商加以改善,并保证产品符合要求才能放行。但很多制造商反馈,不符合没有完全考虑风险的因素,对有些不符合的判定提出质疑,且缺少文件会导致不符合的升级,也会导致体系的文件增多,而使体系复杂化。
四是MDSAP的审核时间主要是按照审核的任务来计算,对大、中、小型的企业审核的时间差异不大。相对于ISO13485对小企业的审核时间,MDSAP对小企业的审核时间充足,但同时也会增加小企业的成本压力。
我国作为IMDRF的成员,曾派出专家参与MDSAP文件的制定工作。但目前我国尚未与其他成员签署MDSAP互认协议。目前,我国对医疗器械的体系检查主要是由政府部门进行,但北京市已于2016年正式通过招标选用了5家第三方机构进行GMP检查,上海和天津等地也在陆续进行第三方GMP审核的试点。MDSAP的审核机构认可、审核模式的策划、审核流程和任务、不符合分类等都可以为我国进行医疗器械体系检查或者是第三方机构的选择提供借鉴。
【本文摘编自《医疗器械蓝皮书(2018)》,作者系英标管理体系认证(北京)有限公司中国区医疗业务总监】

