
血液透析是急慢性肾功能衰竭患者肾脏替代治疗方法之一。血液透析的过程是先将体内血液引流至体外一个由无数根空心纤维组成的透析器中,血液与含机体浓度相似的电解质溶液(透析液)在空心纤维内通过物质交换清除体内的代谢废物,维持电解质和酸碱平衡,同时清除体内过多的水分,并将经过净化的血液回输。其中,血液净化装置的体外循环管路(以下简称“血路”)在血液净化时,作为血液的流通管道使用。
血路在临床透析过程中与透析器相连接,并与透析机协作来完成透析治疗,是一种血液体外输送管道。产品主要部件采用医用级聚氯乙烯(PVC)、PP、PC、ABS材料制造,其光滑的内壁可有效降低血液流动阻力并减少气泡产生,管壁弹性好,有效保证血液流率,从而确保达到预期的透析效果。
整套血路由动脉管路和静脉管路及附属配件组成,其动脉管接头(红色)和静脉管接头(蓝色)可分别与透析器的动、静脉接口连接,主要为血液净化过程中血液和补充液的体外循环提供通道。一次性无菌血液回路属于第三类无源医疗器械产品。
风险监测情况
血路作为无菌医疗器械,首先需要满足无菌医疗器械的监管要求。在产品技术上,主要遵循《血液透析及相关治疗血液净化装置的体外循环血路》(YY0267)标准的要求。因此,血路的日常生产过程控制中,需要参考相关监管要求,结合产品风险,建立合适的风险监控点。结合产品具体工艺生产过程,对每一个过程和环节进行梳理,识别可能的风险,制定风险控制措施,开展控制措施的有效性验证,保障风险控制措施的有效性在可接受水平范围内。
血路在临床发生的常见不良事件包括:引流袋漏液;传感器、保护器出现漏气;滴口室上端漏血;连接导管的接头难以分离;配件出现脱落;设备配合的适应性不符;出现凝血等。这些问题可能导致的临床结果主要有:操作失败,需要更换血路重新操作;血液损失,对患者身体造成影响等。
不良事件由多重因素造成,如器械本身质量、过程监控、医护人员是否按照说明书要求进行操作、医护人员对手术操作的熟练程度等均会引发并发症的出现。为避免不良事件出现,企业应该确保产品符合各相关标准规定的性能,加强原材料及供应商管控,加强内部质量控制措施。除了提升器械本身的质量性能外,操作者应遵循操作说明指引,并结合实际的临床经验来使用产品,同时还要提升医护人员的操作水平,规范操作过程,对于不同患者个体给出不同的合理治疗方案等。
风险点分析
在采购环节,原材料作为血路的组件组成部分,其材料本身的质量对于半成品、最终产品的性能至关重要。不同物料种类对产品性能的影响程度不同,相同物料的不同性能(物理、化学、微生物等)也对产品性能的影响程度不同。基于此,对于物料的管理主要有以下方式:一是供方管理,建立供应商质量管理流程和材料质量标准,开展供方评价和物料材料评价工作,确保有资质、有生产能力且生产质量稳定的供应商才能够纳入合格供方清单内,降低供方供货能力导致的物料异常,进而对产品质量产生影响。二是原材料质量检验,建立质量检验和测试能力,包括测试设备、测试方法、测试人员等。建立原材料进货作业指导书,对材料质量进行检验,在流转到生产加工工序前,识别材料可能的异常,将风险控制在前端。三是开展原材料有效期验证,对于一些高分子材料,原材料可能在存储过程中发生质量损失或质量失效的情况,需开展原材料有效期验证,确定原材料可以使用的时间。同样,对于一些可能受存储环境(如温度、湿度、光照等)影响的物料,需结合存储环境的研究,确定物料最佳存储环境要求,以防不适当的存储造成物料质量下降或失效,进而影响产品质量。
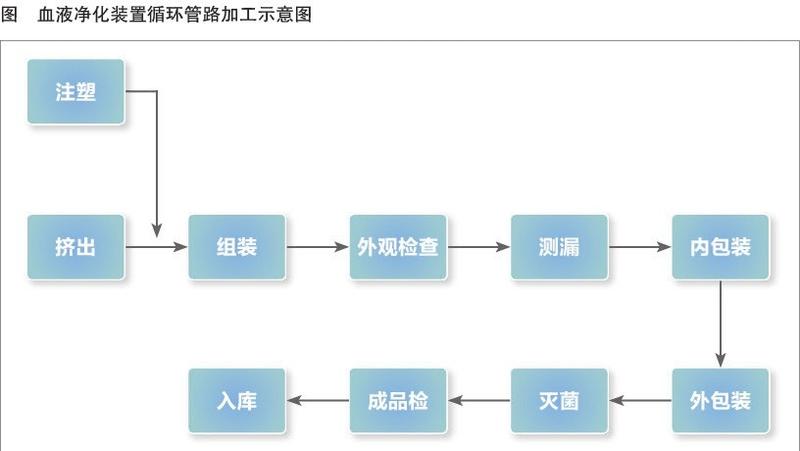
在生产管理环节,目前血液净化装置的体外循环管路生产过程包括注塑、挤出、组装、外观检查、测漏、内包装、外包装、灭菌、成品检、入库等(见附图)。生产过程控制决定产品生产的质量水平,尤其是关键和/或特殊工序,其过程控制尤为重要。
所谓关键工序是指对产品质量起决定性作用的工序;特殊过程是指对形成的产品是否合格不易或者不能通过其后的监视和测量加以验证的过程。基于这个准则不难发现,灭菌工序既是关键工序又是特殊工序。血液净化装置的体外循环管路一般采用环氧乙烷灭菌方式,对灭菌效果的影响因素主要包括温度、压力、湿度、环氧乙烷浓度、灭菌时间。对于血路的环氧乙烷灭菌过程,需要基于环氧乙烷灭菌相关标准,参考过程确认相关程序文件要求,对灭菌过程进行安装确认(IQ),运行确认(OQ)和性能确认(PQ),确定灭菌工艺有效性,保障灭菌过程的可控性,确保灭菌后产品的性能满足要求。
针对确认通过的参数,形成可控的标准作业指导书和灭菌参数,确保产品灭菌过程按照标准化的方式进行,同时保留相应的过程记录,保障可追溯性。另外,当发生关键设备变更或有质量显著变化时,需要重新开展再确认工作。即使没有发生类似变化,也需要开展定期性的再确认(如年度性再确认),可通过重新确认或数据回顾等方式开展。
在质量控制环节,生产组装线主要以人员操作组装完成,因此人员的操作熟练水平与生产产品的品质质量息息相关,需要定期对操作人员进行培训和制定作业指导书,要求每一位操作人员必须培训合格后才能上岗。在实际的生产过程中会出现组装错误,为避免出现这类错误,企业应制定各工位的操作作业指导书,员工按照操作作业指导书进行生产,定期进行培训和考核。第三类医疗产品的组装工序较多,出现组装错误的概率相对较高,因此,还应重点培训和增强员工的产品品质意识,并实行监督机制,确保产品安全有效。
血路产品为无菌产品,内包装的好坏和对微生物的屏蔽阻隔作用对产品的安全有效性相当重要。包装设备在实现包装产品的过程中出现异常时,包装很可能会出现失效,使产品与外部接触,造成产品污染,因此,需要对包装设备进行管控。一是需要对设备进行安装确认(IQ)、运行确认(OQ)和性能确认(PQ),确认设备有效性,保证稳定生产;二是制定设备操作作业指导书,员工需要培训考核合格后才可以操作设备;三是制定设备工艺卡,员工需要严格按照工艺卡内容操作设备;四是制定设备点检要求,定期对设备进行点检,及时发现设备问题,及时处理;五是制定设备维护保养计划,定期对设备进行维护保养,确保设备性能稳定。
(作者单位:广东省医疗器械质量监督检验所)

