
麻醉穿刺包临床适用于实施硬脊膜外腔神经阻滞、蛛网膜下腔阻滞麻醉方法进行穿刺、注射药物。其基本配置为麻醉用针、麻醉用过滤器、麻醉导管及接头,可选配全玻璃注射器、注射器、注射针、手套、纱布、棉球等组件方便临床使用。麻醉包可分以下几类:硬膜外麻醉、腰椎麻醉及腰-硬联合麻醉。
麻醉穿刺包在我国按第三类医疗器械进行管理,作为无菌医疗器械,产品性能应符合YY0321.1-2009《一次性使用麻醉穿刺包》、YY0321.2-2009《一次性使用麻醉用针》、YY0321.3-2009《一次性使用麻醉用过滤器》等行业标准要求,还应满足我国《医疗器械生产质量管理规范》的监管要求。
风险监测情况
参考《医疗器械监督管理条例》《医疗器械不良事件监测和再评价管理办法》《医疗器械召回管理办法》《医疗器械不良事件监测工作指南(试行)》和行业官网公布的相关信息可知,麻醉穿刺包产品的不良事件包括置管困难、导管折断、药液输注不畅、组件配合不良等。以上情况可能导致操作失败,需更换麻醉穿刺包重新操作。不良事件的发生可能由多种因素造成,如产品质量、术者操作等。因此,除提升医疗器械质量外,还应提高操作者的操作技能水平。对麻醉穿刺包生产厂家来说,应确保产品符合相关标准规定的性能,加强内部质量控制措施,保证手术安全性,降低不良事件发生率。
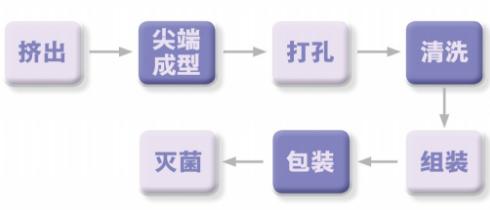
图为麻醉穿刺包的主要生产过程。
风险点分析
就高分子耗材产品而言,原材料本身的质量对半成品、最终产品的性能有着很大影响。因此应加强对原材料的管理,主要措施如下:
第一,根据产品的性能要求选择合适的材料,对与人体或药液直接或间接接触的材料,不仅关注其机械化学性能,还要注意选择具有良好生物相容性的材料。
第二,根据对产品质量的影响程度,将原材料分为关键物料、重要物料和一般物料。针对不同类别原材料的要求,对供方开展评审,然后进行采购,在进货质量监控时采用的手段也不同。
在生产管理环节,生产过程控制决定了所生产产品的质量水平,尤其对关键/特殊工序来说,过程控制尤为重要。应对麻醉穿刺包生产过程中的挤出、打孔和灭菌等关键/特殊工序进行风险点监测。
在挤出环节,挤出成型有缺陷,或产品配合出现问题,均会导致产品不能正常使用,贻误治疗。对此可通过严格执行《麻醉导管挤出工艺卡》《麻醉穿刺包生产过程质量控制点》进行初步控制。
在打孔环节,打孔不合格或流量偏小会导致产品不能正常使用,贻误治疗。对此可通过严格执行《麻醉导管打孔工艺卡》《麻醉穿刺包生产过程质量控制点》进行初步控制。
在灭菌环节,若由于灭菌不彻底而使患者接触到被细菌污染的产品,可能导致感染,严重时可能导致死亡;若由于产品灭菌后环氧乙烷解析不彻底而使患者接触到环氧乙烷残留量超标的产品,可能引起患者机体发热等不良反应。对此,应严格执行《灭菌控制程序》,按规定进行产品灭菌及环氧乙烷解析。
(作者单位:广东省药品监管局)

