- 国家市场监督管理总局
- 国家药品监督管理局
- 中国健康传媒集团主办
- 中央新闻网站
上海药物所等解析非酒精性脂肪肝病线粒体稳态失衡新分子机制并提出原始创新药物靶标
近年来,非酒精性脂肪性肝病(NAFLD)及非酒精性脂肪肝炎(NASH)在全球快速蔓延,却尚未有明确靶向与显著疗效的药物上市。据报道,2019年非酒精性脂肪性肝病全球患病率高达25%,流行病学研究更提示我国已成为世界上非酒精性脂肪肝患病人数最多和患病人数增长最快的国家。因此,迫切需要寻找有效的干预治疗方法。
既往研究表明,非酒精性脂肪性肝病肝组织中有病理性RNA选择性剪接因子(如SRSF3、SRSF10等)的表达,提示RNA选择性剪接在NAFLD/NASH中的关键病理作用。线粒体稳态平衡对于细胞能量代谢及信号通路调控起决定性作用,其稳态失衡是非酒精性脂肪性肝病、肥胖等代谢性疾病的关键病理原因。多项研究表明,线粒体功能相关基因如Drp1, OPA1, Cpt1a等均存在多个剪接子,其活性差异与剪接型序列相关。
中国科学院上海药物研究所李静雅研究团队致力于探索代谢性疾病中的线粒体稳态失衡分子机制。近年来,针对营养诱导的疾病模型肝组织与脂肪组织中线粒体生物合成的调节失衡,该团队开展调控机制以及干预策略研究。谭敏佳课题组主要从事基于蛋白组学技术的蛋白修饰调控机制和药物精准干预策略研究,近期的研究工作突破了对多种蛋白翻译后修饰在生理病理过程中的多样性、动态性、交互性等复杂特征的认知局限。
10月5日,上海药物所李静雅课题组与谭敏佳课题组,联合复旦大学附属医院中山医院高鑫/夏明锋团队,在Cell Metabolism在线发表了研究长文,首次揭示了死亡相关凋亡诱导蛋白激酶DRAK2通过RNA剪接因子SRSF6通路导致线粒体相关基因(包括mtDNA聚合酶POLγ2)的可变剪接异常,并且充分论证这种线粒体功能相关基因的可变剪接异常是非酒精性脂肪肝病发生发展的关键病理分子机制。
该项研究中,研究团队发现DRAK2在NAFLD/NASH模型小鼠以及病人的肝穿刺组织中,表达均显著升高,且与NASH病理评分呈正相关。为探究其病理中的功能,研究人员构建了肝脏DRAK2高表达与敲低、及肝脏特异性敲除(Drak2-HKO)等小鼠,揭示DRAK2参与调控线粒体功能并介导非酒精性脂肪肝病的病理发展进程。机制研究方面,基于磷酸化修饰组学研究、蛋白相互作用质谱组学研究以及转录组学等多维度分析,阐明DRAK2通过RNA剪接因子SRSF6调节线粒体功能相关基因的选择性剪接,抑制线粒体生物合成与功能、促进NAFLD/NASH病理进程。最后,研究人员还利用已报道的DRAK2小分子抑制剂22b探究其对非酒精性脂肪肝病的药理性干预作用,进一步论证了非酒精性脂肪肝病病理进程中DRAK2-SRSF6这一全新分子机制,并提示其作为新靶向策略干预非酒精性脂肪肝炎的可行性。
该项研究首次发现非酒精性脂肪肝病病理进程中线粒体功能相关蛋白的RNA选择性剪接失调,揭示了非酒精性脂肪肝病的线粒体稳态失衡新分子机制,为NASH的创新药物研发提供了原始创新药物靶标以及可能的干预手段,具有转化价值与临床意义。
该工作得到国家自然科学基金委、国家重大科技专项、国家重点研发计划及上海市自然基金委等项目的资助。
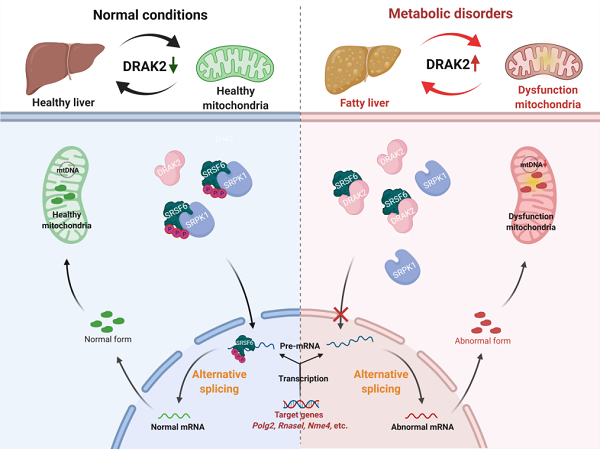
DRAK2-SRSF6介导非酒精性脂肪肝炎的分子机制
(责任编辑:刘思慧)
分享至
右键点击另存二维码!