- 国家市场监督管理总局
- 国家药品监督管理局
- 中国健康传媒集团主办
- 中央新闻网站
CAR-T疗法的局限性及研发方向
CAR-T疗法在治疗急性白血病和非霍奇金淋巴瘤上具有显著疗效,为部分复发或难治性血液肿瘤患者带来了新希望,但CAR-T疗法作为一个新兴领域,目前也存在一些局限性。
CAR-T疗法的局限性
一是已知的毒副作用。目前已知CAR-T疗法的毒副作用包括:细胞因子风暴或细胞因子释放综合征(CRS)、神经毒性和脱靶效应等。
CRS主要表现为高烧、肌肉酸痛、呕吐、心动过速/低血压、弥漫性血管内凝血、心肺功能障碍等症状。轻度CRS可通过辅助疗法加以治疗,如使用类固醇药物或者细胞因子阻断性药物;重度CRS还需依靠血管活性升压药、抗癫痫药等缓解症状。神经毒性临床上多呈现患者意识混乱、失语、脑水肿等症状,通常在CAR-T细胞回输后的第4~5天产生,目前该副作用的发生机制尚不十分明确,出现轻微临床体征的患者可在几天后自行缓解;严重情况下需配合地塞米松辅助治疗,通常可在约4周内缓解。脱靶效应是指CAR-T细胞在攻击肿瘤细胞时,误伤了同样表达靶点抗原的正常组织细胞,从而引起正常组织损伤或免疫缺陷,严重时会导致患者死亡。脱靶效应是CAR-T疗法最主要的毒副作用之一。
二是治疗效果待提高。仅从短时间内的治疗效果看,CAR-T疗法对某些血液肿瘤的治疗效果十分显著,但若将观察期限进一步延长则发现,许多患者在经过CAR-T治疗几个月或更长时间后,会出现肿瘤复发的现象,影响患者预后。
和血液肿瘤相比,CAR-T疗法在实体瘤方面遇到的问题更为棘手。一方面,实体瘤发生部位不像血液系统散布全身,CAR-T细胞需抵达实体瘤病灶,并浸润到肿瘤内部;另一方面,即使CAR-T细胞能够浸润到实体瘤内部,也会面临其内部免疫微环境的抑制,影响T细胞正常发挥作用。此外,实体瘤内部微环境存在偏酸、缺氧及营养缺乏等情况,也不利于CAR-T细胞发挥作用。
三是难以产业化。CAR-T疗法费用昂贵。目前,已获批的CAR-T产品和绝大多数CAR-T临床试验都是使用自体型CAR-T,即以患者自身的T细胞为起始材料,这种“私人订制”疗法的生产成本较高。诺华、Kite获批的CAR-T产品定价分别为47.5万美元、37.3万美元,高昂的价格限制了其市场潜力。诺华旗下的CAR-T产品在2018年第一季度取得了1200万美元的营收,只达到了预期的三成;Kite的CAR-T产品在获批后两个月内的销售额也不及预期。
除费用高昂外,CAR-T疗法质量稳定性也比较差。患者自身的T细胞通常都存在质量与数量的缺陷,不同批次产品之间质量的稳定性较差,难以达到大规模的工业化生产及标准化的质量控制。
CAR-T的研发方向
基于CAR-T治疗暴露出的局限性,目前有关CAR-T的研究和开发,主要围绕以下三方面展开:
一是降低CAR-T细胞毒性。CAR-T疗法表现出的毒副作用说明,需要开发一些控制程序来调控CAR的活性。目前已经有大量方法用于控制CAR-T的安全性,比如通过安装自杀开关对移植细胞进行快速清除,这种开关可通过小分子或者抗体来控制。常用的自杀开关包括可诱导的caspase-9(iCasp9)、单纯疱疹病毒中的胸苷激酶(HSV-TK)及自杀表位等。但自杀开关也会清除治疗性的CAR-T细胞,引发治疗反应的不可逆终止。因此,不清除CAR-T细胞的非细胞毒性的可逆系统对于控制毒性反应也许是有用的。这种可逆系统可以通过可诱导的CAR来实现,主要有三种方式:可诱导的表达、药物诱导的CAR组装、可开关控制的CAR。
目前CAR-T靶向的抗原大都为肿瘤相关抗原,在肿瘤细胞表面过度表达,在正常组织中也有低表达。因此CAR-T疗法会出现脱靶效应,攻击正常组织。“逻辑门”的设计可以减少对正常组织的杀伤,该设计主要有三种形式,即基于Notch的组装式受体(SynNotch受体)、抑制性CAR(iCAR)、双特异性CAR。
此外,CAR-T的安全性也可通过空间位置加以调控,主要是通过肿瘤微环境的感知,使CAR-T细胞只能在肿瘤位点激活,进而杀伤肿瘤细胞。目前这种设计主要有三种方式:“蒙面”CAR、“氧敏”CAR、感知“危险信号”CAR。
二是提高CAR-T治疗的有效性,尤其在实体瘤中。针对经CAR-T治疗后血液肿瘤可能再次复发的问题,可以设计同时靶向CD19与CD22分子的双CAR-T。已有研究发现,在CAR-T治疗过程中,一些原本表达CD19的癌细胞可能转而表达CD22蛋白,因此CD19、CD22双管齐下,理论上能增强CAR-T的效果。
当前,改善CAR-T疗法在实体瘤中的治疗效果面临巨大的阻碍。一方面,肿瘤微环境中存在物理屏障,不利于T细胞效应功能发挥的生化和代谢环境,肿瘤细胞表达或分泌的抑制分子以及大量基质细胞,T细胞必须克服肿瘤微环境中的这些障碍才能杀伤肿瘤;另一方面,在细胞功能失调或者耗竭前,T细胞激活还需维持,用于清除肿瘤。最理想的状态是,在肿瘤消除后,CAR-T细胞仍能维持并形成能提供长期保护的记忆性细胞。
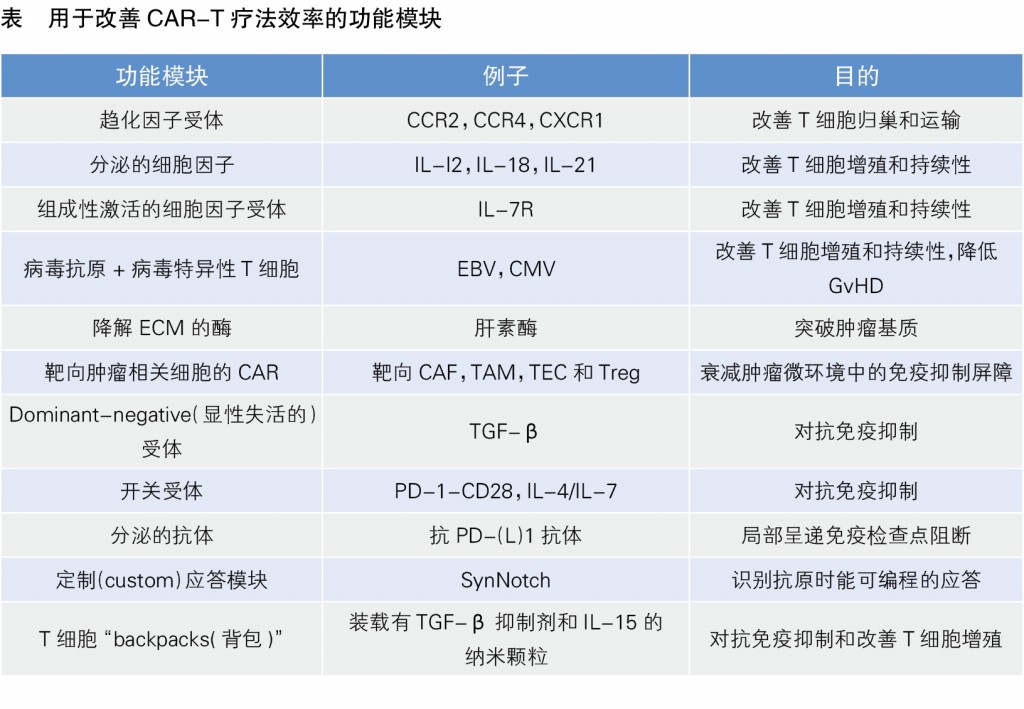
目前,已经有一些功能性模块用于CAR-T细胞的工程化,将这些模块与CAR-T细胞联合治疗,或可克服以上阻碍(见表)。
三是开发通用型CAR-T。目前全球主要有12家公司从事通用型CAR-T开发。
为患者打造专属的治疗方式,必然价格不菲,但必须正视的是,无论是对商家还是患者来说,高成本的“个体化生产”以及“个体化治疗”所具有的临床效益都是有限的。因此,将CAR-T转变为“off-the-shelf”供应链,具备能规模化生产、剂量恒定、疗效优越等优点才是大势所趋。目前,虽然大多数通用CAR-T的研发还处在临床前或临床早期阶段,但其极具吸引力的治疗潜力足以作为继续研发的强大推动力。当前已有两款CAR-T疗法上市。如果通用型CAR-T疗法能够顺利问世,对于患者来说又多了一个全新的治疗方案。而且,如果异体CAR-T最终可行,单例治疗价格有望大幅下降,生产效率也会大幅提升,CAR-T治疗领域也将迎来重要变革。
(责任编辑:)
分享至
右键点击另存二维码!