- 国家市场监督管理总局
- 国家药品监督管理局
- 中国健康传媒集团主办
- 中央新闻网站
国产第二款CAR-T细胞疗法问世
近日,国家药监局官网公告,药明巨诺申报的1类新药,靶向CD19的CAR-T产品瑞基奥仑赛注射在国内获批上市,用于治疗经过二线或以上全身性治疗的复发或难治性大B细胞淋巴瘤(LBCL)成人患者。这距离今年6月22日我国首款CAR-T细胞治疗产品复星凯特的阿基仑赛获批仅仅过去两个多月,值得一提的是,这是全球第六款CAR-T细胞治疗产品。
与阿基仑赛由Kite Pharma的Yescarta经过技术转移而进行本地化生产得来不同的是,瑞基奥仑赛是建立在美国Juno公司Liso-cel基础上,自主研发的CAR-T疗法,是我国首款1类生物制品的CAR-T产品。
CAR-T疗法也称为“嵌合抗原受体T细胞疗法”。本来人体的T细胞可以杀灭癌细胞,但是因为其他种种原因,癌症患者体内的T细胞丧失了这种功能,CAR-T疗法就是将癌症患者体内的T细胞分离出来,利用基因工程对其进行改造,给T细胞装上识别癌细胞表面抗原的“嵌合抗原受体”(CAR),让它们恢复抗击癌细胞的功能,然后再把它们输回人体去对抗癌细胞,从而达到治疗癌症的作用。
在一项名为RELIANCE的前瞻性、单臂、多中心、Ⅱ期关键性研究中,瑞基奥仑赛注射液治疗中国复发或难治性大B细胞淋巴瘤患者,取得了积极的结果。根据药明巨诺在2020年美国血液学会(ASH)年会公布的数据,在58例可评估有效性的患者中,最佳客观缓解率为75.9%,最佳完全缓解率为51.7%。中位随访时间8.9个月,未达到中位总生存期(OS),6个月缓解持续时间(DOR)、无进展生存期(PFS)和OS分别为60.0%、54.2%和90.8%。在安全性方面,在59例接受治疗的患者中,28位患者(47.5%)出现了不同等级的细胞因子释放综合征(CRS)。研究人员曾指出,这一结果表明,瑞基奥仑赛注射液在接受既往重度治疗且风险较高的复发或难治性大B细胞淋巴瘤患者中的安全性可能会更好。Insight数据库显示,目前药明巨诺瑞基奥仑赛注射液在国内登记了4项临床,包括2项Ⅱ期临床,分别针对复发难治性B细胞非霍奇金淋巴瘤和复发难治性套细胞淋巴瘤。药明巨诺是国内首个获得以CD19为靶点的CAR-T细胞治疗产品IND临床批件的企业,领跑我国CAR-T临床研究。
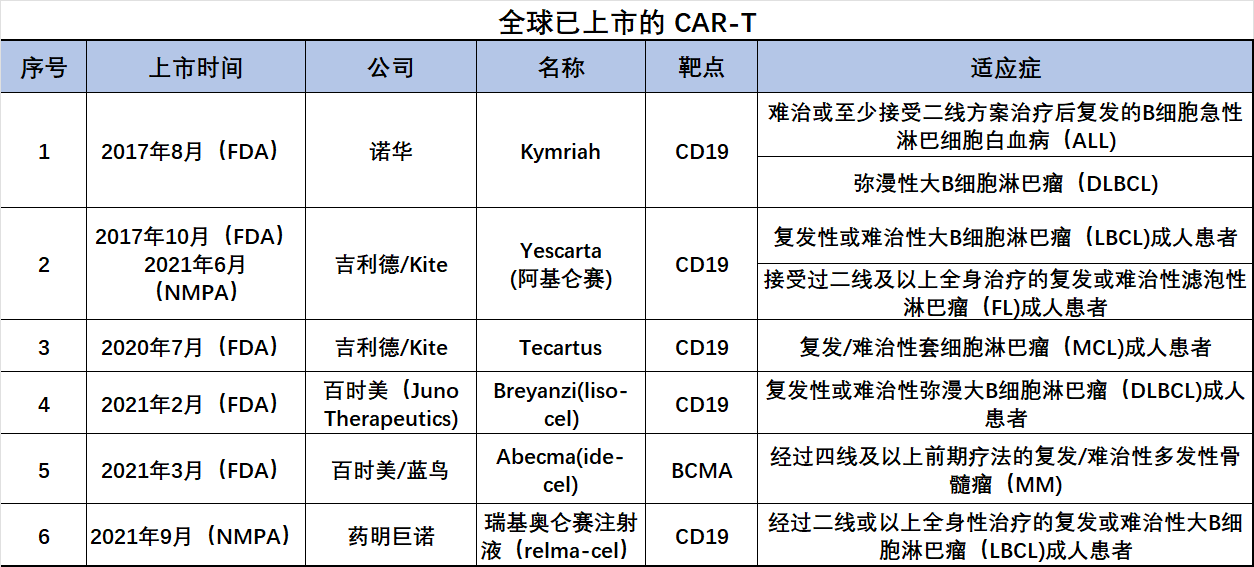
图1.全球已上市CAR-T产品
数据来源:各公司官网
关于CAR-T疗法的价格,目前国外诺华的Kymriah为47.5万美元;吉利德的Yescarta为37.3万美元;百时美的Abecma41.95美元;Breyanzi41.03万美元;复星凯特引进的Yescarta,国内药名阿基仑赛,国内定价尚未得知;刚刚获批的瑞基奥仑赛也尚未确定价格。
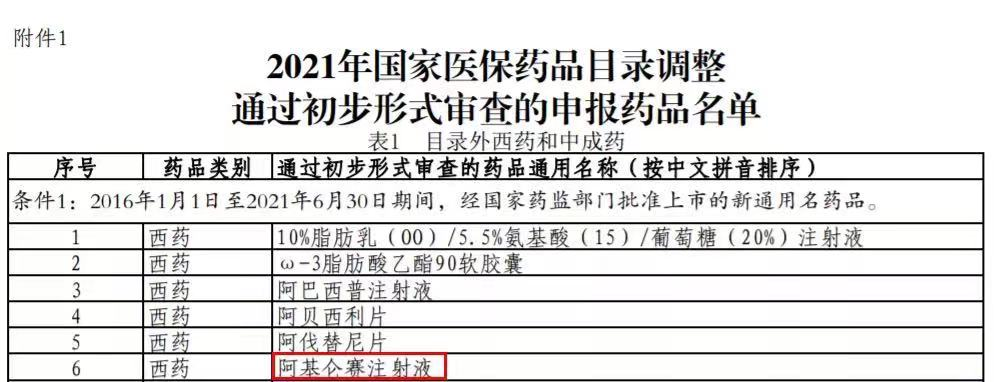
图2.医保药品目录调整初步形式审查的申报药品名单
来源:国家医保局网站
7月30日,国家医保局发布《关于公示2021年国家医保药品目录调整通过初步形式审查药品及信息的公告》,复星凯特的阿基仑赛注射液也被纳入其中。复星凯特方面透露,公司正在主动配合国家医保部门以提升患者的用药可及性。从时间上来看,药明巨诺的瑞基奥仑赛注射液已无缘此次医保谈判。我国医保主要强调“保基本”的功能定位,国家医保局也明确表示,一些价格较为昂贵的药品通过了初步形式审查,仅表示经初步审核该药品符合申报条件,获得了进入下一个调整环节的资格。这类药品最终能否进入国家医保药品目录,还要接受包括经济性等方面的严格评审,独家药品还要经过价格谈判,谈判成功的才能进入目录。在没有竞品上市之前,CAR-T疗法还可以继续保持高价,但是随着获批企业越来越多,相信价格也会逐渐下调,例如PD-1。
近年来,资本涌入CAR-T赛道,不少企业纷纷融资、上市,头部企业有复星凯特、药明巨诺、传奇生物、永泰生物、科济生物等。临床试验也呈井喷之势。据兴业证券研报数据,目前美国和中国对于细胞治疗的研究数量为全球最多。2020-2021年,美国IND的数量从479起增长到654起,中国IND的数量从264起增长到420起。随着CAR-T热度上升,越来越多的国内企业涌入赛道,主要分为三类,一是与海外大型药企合资,进行成熟产品的引进与本地化生产,比如复星凯特;二是寻求全球化合作,比如传奇生物;三是自主研发,如永泰生物、科济生物等。毫无疑问,CAR-T赛道具有较好的市场前景。根据弗若斯特沙利文数据,全球CAR-T细胞治疗市场从2017年的0.1亿美元增长到2020年的11亿美元。预计2030年市场将进一步增长至218亿美元,2024-2030年复合年增长率为22.1%。而我国CAR-T市场有望在2021年启动增长,市场规模为2亿元人民币,预计2024年和2030年市场规模将分别进一步增长至53亿元和289亿元,2024-2030年复合年增长率将达到32.6%。
值得一提的是,传奇生物BCMA CAR-T ciltacabtagene autoleucel(cilta-cel)也已进入临床试验后期阶段,该产品获得了我国首个突破性疗法认定。今年5月,cilta-cel的生物制品许可申请(BLA)获得美国FDA受理。如果cilta-cel最终能够顺利获批,那么我国首款国产CAR-T疗法将正式走出国门,进军国际市场。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!