- 国家市场监督管理总局
- 国家药品监督管理局
- 中国健康传媒集团主办
- 中央新闻网站
2024年12月中美欧批准上市新药盘点 我国批准16款新药上市
统计显示,2024年12月,中国批准上市的新药数量为16款,其中有两款是我国自主研发的新药;美国批准8款新药上市;欧盟批准1款新药上市。
中国批准16款新药上市
2024年12月,我国批准了16款新药上市。根据Pharmadigger数据库,利那拉生酯、森格列汀和塔戈利单抗为全球首次批准上市新药,其中森格列汀和塔戈利单抗为我国自主研发的新药。
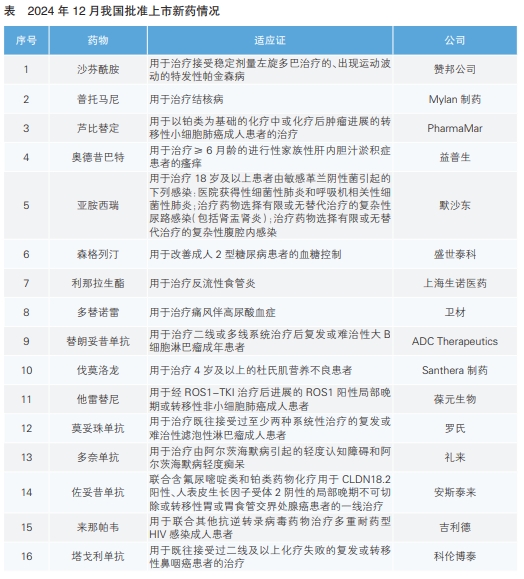
沙芬酰胺(又名:沙非胺)是赞邦公司研发的一款选择性单胺氧化酶B抑制剂,可以调节谷氨酸盐异常释放。帕金森病是一种中老年神经系统退行性疾病,随着疾病进展和左旋多巴(临床上改善帕金森病患者症状的标准疗法)的长期使用,大多数患者会对药物敏感度下降,产生症状波动。在“开启”期,患者的运动能力一切正常;而在“关闭”期,患者运动能力会出现明显下降。该药此次获批是基于一项名为XINDI的Ⅲ期临床试验,结果显示与服用安慰剂的患者相比,服用沙芬酰胺的患者“开启”期显著延长,“关闭”期则有所缩短。沙芬酰胺此前已于2015年在欧盟获批上市。
普托马尼是全球非营利性药物研发联盟结核病联盟研发的一种硝基咪唑类抗生素,具有独特的结构和抗结核作用机制,对结核分枝杆菌有很高的特异性。2020年1月,结核病联盟将该药在中国的销售许可授权给Mylan制药和复星医药全资子公司红旗制药。普托马尼与贝达喹啉和利奈唑胺组成的治疗方案具有疗程短、全程口服、治疗依从性高等优势。普托马尼此前已于2019年在美国获批上市。
芦比替定是绿叶制药从PharmaMar引进的一种选择性致癌基因转录抑制剂,在抑制肿瘤基因转录、导致肿瘤细胞凋亡的同时,还可以调节肿瘤微环境,进一步发挥抗肿瘤作用。小细胞肺癌(SCLC)占肺癌的13%~17%,是最具侵袭性的肺癌亚型之一,5年总生存率低于10%。该药此次在中国获批是基于两项临床试验结果,其中一项为在海外开展的Ⅱ期关键临床试验,结果显示,使用芦比替定单药治疗接受铂类药物化疗后出现疾病进展的SCLC成人患者,有约35%的患者获得客观缓解,中位缓解持续时间为5.3个月;另一项是芦比替定针对中国人群的桥接试验,结果显示有约45%的患者获得客观缓解,中位缓解持续时间为4.2个月、中位无进展生存期为5.6个月、中位生存期为11.0个月。芦比替定此前已于2020年在美国获批上市。
奥德昔巴特是益普生研发的一种回肠黏膜细胞胆汁酸转运蛋白抑制剂,可以阻断肠胆汁酸经过肠肝循环回流入肝,从而减轻肝脏内及循环内的胆汁酸浓度。该药此次获批的适应证为治疗≥6月龄的进行性家族性肝内胆汁淤积症患者的瘙痒。奥德昔巴特此前已于2021年在美国和欧盟获批上市。
亚胺西瑞(亚胺培南500mg+西司他丁500mg+瑞来巴坦250mg)是默沙东研发的复方制剂。亚胺培南是一种β-内酰胺类抗生素;西司他丁可防止亚胺培南被肾脏分解;瑞来巴坦是一种二氮杂双环辛烷β-内酰胺酶抑制剂,可以增强β-内酰胺类抗生素的活性。亚胺西瑞此前已于2019年在美国获批上市。
森格列汀是盛世泰科生物医药技术(苏州)股份有限公司自主研发的新一代高选择性二肽基肽酶4(DPP-4)抑制剂。该药不仅能够抑制DPP-4,阻止其对胰高血糖素样肽-1和葡萄糖依赖性促胰岛素分泌多肽进行灭活,从而促进胰岛素释放;还能抑制胰岛α细胞分泌胰高血糖素,降低血糖且不易诱发低血糖和增加体重。该药此次获批是基于两项在中国进行的Ⅲ期关键临床试验,共涉及约1000例2型糖尿病受试者。结果显示,在单药治疗研究中,森格列汀50mg与100mg剂量组在第24周末糖化血红蛋白降低值均约为1%;在该药联合二甲双胍治疗的研究中,这两个剂量组在第24周末糖化血红蛋白降低值均约为1.2%。同时,两组试验数据均显示,血糖水平更高的患者,糖化血红蛋白下降幅度更大。
利那拉生酯是上海生诺医药科技有限公司与Cinclus Pharma合作开发的一款新一代钾离子竞争性酸阻断剂(P-CAB)口服药物。P-CAB可竞争性阻断H+/K+-ATP酶(质子泵)中钾离子的活性,进而抑制胃酸分泌。该药此次获批的适应证为用于反流性食管炎的治疗。
多替诺雷是卫材研发的新型尿酸盐重吸收抑制剂,可选择性抑制尿酸盐重吸收,有效抑制肾近端小管尿酸转运蛋白URAT1,而不影响尿酸排泄因子ABCG2和OAT1/3的功能,降血尿酸效率较高。多替诺雷是我国首个获批上市的高选择性URAT1抑制剂。该药此次获批是基于一项在中国的Ⅲ期临床试验。试验结果显示,使用4mg多替诺雷治疗24周后,血尿酸≤6mg/dL的患者比例显著高于40mg非布司他组。多替诺雷此前已于2020年在日本获批上市。
替朗妥昔单抗是ADC Therapeutics研发的一种将抗CD19单克隆抗体与小分子药物SG3199(吡咯并苯二氮杂卓二聚体细胞毒素)偶联的抗体偶联药物(ADC),获批的适应证为治疗二线或多线系统治疗后复发或难治性大B细胞淋巴瘤成年患者。该药是我国首个获批上市的靶向CD19的ADC药物,此次获批是基于OLADCT-402-001研究的积极数据。该药此前已于2021年在美国获批上市。
伐莫洛龙是由Santhera制药研发的一种新型解离性皮质类固醇,是我国首个获批用于治疗杜氏肌营养不良的药物。在关键性研究Vision-DMD中,伐莫洛龙6mg/kg/天和足量泼尼松0.75mg/kg/天的疗效在所有运动功能中相似。2022年,曙方医药从Santhera制药获得伐莫洛龙在中国和东南亚地区用于杜氏肌营养不良和其他罕见病适应证的独家开发和商业化权益。伐莫洛龙此前已于2023年在美国获批上市。
他雷替尼是葆元生物医药科技(杭州)有限公司于2018年从第一三共引进的新一代ROS1酪氨酸激酶抑制剂。中国约有3%的非小细胞肺癌(NSCLC)患者携带ROS1阳性基因。该药此次获批是基于一项Ⅱ期临床研究TRUST-I的积极结果。结果显示,在106名既往未接受过靶向治疗的初治患者中,有约90%的患者获得客观缓解。
莫妥珠单抗是罗氏研发的一款CD20/CD3 T细胞衔接双特异性抗体,旨在靶向B细胞表面的CD20和T细胞表面的CD3。这种双重靶向可以激活并重定向患者现有的T细胞,通过将细胞毒性蛋白释放到B细胞中,消除恶性B细胞。莫妥珠单抗此前已于2022年6月和12月在欧盟和美国获批上市,都是基于开放标签、多中心、Ⅰ/Ⅱ期临床研究GO29781的积极结果。该项研究中,莫妥珠单抗显示出较高的完全缓解率和长久的临床疗效,中位随访18.3个月后,患者的客观缓解率为80%,完全缓解率为60%。
多奈单抗是礼来研发的一款靶向修饰化β淀粉样蛋白斑块的抗体药物,可以快速清除淀粉样蛋白斑块。大脑中淀粉样斑块积聚可能引起思维和记忆问题,与阿尔茨海默病的发生有关。多奈单抗是唯一一个有证据支持在清除淀粉样蛋白斑块后可停药的靶向淀粉样蛋白的疗法,此前已于2024年7月在美国获批上市。
佐妥昔单抗是安斯泰来研发的一种抗Claudin 18剪接变体2(CLDN18.2)人鼠嵌合IgG1单克隆抗体,可特异性与CLDN18.2结合,诱导产生抗体依赖性细胞毒作用和补体依赖性细胞毒作用。佐妥昔单抗是我国批准的首个靶向胃部肿瘤细胞表达生物标记物CLDN 18.2的单克隆抗体。该药本次获批是基于名为GLOW和SPOTLIGHT的两项Ⅲ期临床研究。研究结果显示,与其他标准化疗相比,符合条件的胃和胃食管交界处腺癌患者使用佐妥昔单抗治疗,无进展生存期和总生存期都有统计学上显著的改善。佐妥昔单抗此前已于2024年3月在日本获批上市。
来那帕韦是吉利德研发的长效HIV衣壳抑制剂,可通过干扰病毒生命周期的多个重要步骤抑制HIV-1的复制,包括抑制由病毒衣壳介导的HIV-1前病毒DNA的摄取、组装和释放,以及病毒衣壳核心的形成,而且对其他现有药物没有已知的交叉耐药性。来那帕韦此前已于2022年在欧盟获批上市。
塔戈利单抗是科伦博泰自主研发的一种人源化PD-L1单抗。鼻咽癌是一种发生于鼻咽部黏膜上皮的恶性肿瘤,是常见的头颈部恶性肿瘤之一。复发或转移性鼻咽癌目前的治疗手段有限,对于一线治疗失败的复发或转移性鼻咽癌患者目前还没有公认的标准治疗方案。该药本次获批主要是基于一项在既往接受过2线及以上系统治疗失败的复发或转移性鼻咽癌患者中开展的单臂Ⅱ期临床试验。中位随访时间为21.7个月时,有约26%的患者获得客观缓解,中位缓解持续时间为12.4个月。
美国批准八款、欧盟批准一款新药上市
2024年12月,美国批准8款新药上市。根据Pharmadigger数据库,除Ensartinib和Concizumab外,其余均为全球范围内首次获批的新药。
Zenocutuzumab是Merus制药研发的一款可以同时与HER2和HER3受体相结合的双特异性抗体。该药可以阻止HER2和HER3形成二聚体,从而阻断神经调节蛋白的信号传导。在NRG1融合阳性的肿瘤患者中,表达神经调节蛋白的NRG1基因由于与其他基因融合,导致神经调节蛋白异常表达,从而促进癌症发生和增殖。Zenocutuzumab是全球首个获批的HER3靶向药,也是美国食品药品管理局(FDA)批准的首个针对NRG1基因融合性胰腺导管腺癌和NSCLC的新疗法。
Crinecerfont是Neurocrine生物制药研发的一种口服、选择性促肾上腺皮质激素释放因子1型受体拮抗剂,可通过激素非依赖性机制减少和控制过量的肾上腺雄激素,用于治疗因21-羟化酶缺乏症导致的先天性肾上腺增生(CAH)。CAH是一组遗传性代谢疾病,大约95%的CAH是由导致21-羟化酶缺乏的突变引起。该药本次获批是基于在182例成人和103例儿童经典CAH患者中开展的两项安慰剂对照试验。结果显示,与安慰剂相比,Crinecerfont治疗组的患者在第4周时的血清雄烯二酮较基线统计学显著降低。
Cosibelimab是Checkpoint Therapeutics研发的一种完全人源化的PD-L1单抗。该药与目前已上市的PD-1/L1抗体药物的差异之处在于,它可以通过持续的高目标肿瘤占位率来重新激活抗肿瘤免疫反应,并能够诱导抗体依赖性细胞介导的细胞毒性的功能性Fc结构域,从而增强潜在疗效。虽然对大多数皮肤鳞状细胞癌(cSCC)患者可以治愈性切除局部肿瘤,但其中相当一部分患者会进展为晚期,并最终导致死亡。Cosibelimab是首个获批用于治疗晚期cSCC患者的PD-L1靶向抗体。该药本次获批是基于一项名为CK-301-101的临床试验,结果显示接受Cosibelimab治疗的cSCC患者约有一半获得客观缓解。
Ensartinib是贝达药业及其控股子公司Xcovery共同开发的高选择性新一代ALK抑制剂。ALK阳性的患者占NSCLC病例中的3%~5%。该药本次获批主要是基于eXALT3研究的结果,与克唑替尼相比,Ensartinib能够延长患者的无进展生存期约40%。2020年11月,Ensartinib在中国获批上市,用于此前接受过克唑替尼治疗后进展的或者对克唑替尼不耐受的ALK阳性的局部晚期或转移性NSCLC患者的治疗;2022年3月Ensartinib在中国获批用于ALK阳性的NSCLC一线治疗。
Olezarsen是Ionis制药研发的一种反义寡核苷酸疗法,旨在抑制机体产生载脂蛋白C-Ⅲ(一种在肝脏中产生的蛋白质,可调节血液中甘油三酯的代谢)。家族性高乳糜微粒血症是一种罕见的遗传性疾病,会导致机体无法有效分解血液中的甘油三酯(TG)。该药本次获批主要是基于一项名为Balance的Ⅲ期临床试验。在Olezarsen治疗组中,从基线到第6个月,TG水平的平均百分比降幅为42.5%,而安慰剂组未表现出类似的下降趋势。从基线开始,TG水平的中位百分比变化和绝对变化显示,在为期12个月的治疗过程中,Olezar sen具有持续而稳定降低患者TG的效果。
Remestemcel-L是Mesoblast公司开发的一种同种异体骨髓来源的间充质基质细胞疗法。它通过抑制T细胞增殖和下调促炎细胞因子和干扰素的产生,来调节T细胞介导的炎症反应。类固醇难治性急性移植物抗宿主病(SRaGVHD)是一种严重且可能危及生命的并发症,通常发生于同种异体造血干细胞移植后。Remestemcel-L是FDA批准的首个间充质基质细胞疗法。本次获批是基于一项54名接受同种异体造血干细胞移植后患有SR-aGVHD的儿童患者参与的试验。试验结果显示,有30%的患者在接受Remestemcel-L治疗28天后达到完全缓解。
Alyftrek(Vanzacaftor/Tezacaftor/ Deutivacaftor)是Vertex制药研发的三联疗法。在囊性纤维化(CF)患者中,CFTR基因的突变会导致细胞表面CFTR蛋白通道的数量和/或功能减少。CFTR蛋白功能缺陷和/或CFTR蛋白缺失会导致盐和水在许多器官的细胞中流入和流出过程不畅。若这种情况在肺部发生,会导致肺部黏液聚集、慢性肺部感染和进行性肺损伤,最终导致患者死亡。Vanzacaftor和Tezacaftor旨在通过促进CFTR蛋白的加工和运输,增加细胞表面CFTR蛋白数量。Deutivacaftor是一种增效剂,旨在增加送达细胞表面的CFTR蛋白的通道开放几率,以改善细胞膜上盐和水的流动。该疗法此次获批主要是基于3项Ⅲ期临床研究的积极结果,其中在SKYLINE 102和SKYLINE 103研究中,Alyftrek均非劣效于Vertex制药此前研发的另一款药物Trikafta(Elexacaftor/Tezacaftor/ Ivacaftor)。
Concizumab是诺和诺德研发的一种组织因子途径抑制剂(TFPI)拮抗剂,旨在阻断体内一种名为TFPI的蛋白质,该蛋白质会阻止血液凝固。通过阻断TFPI,Concizumab能够在抑制物存在的情况下,增强凝血酶的生成,从而弥补其他凝血因子的缺失或不足。血友病A和血友病B是罕见的遗传性出血性疾病。患者由于缺乏凝血蛋白,导致凝血功能不正常,受伤或手术后出血时间比正常时间长。该药本次获批是基于一项名为explorer7的Ⅲ期临床试验的积极结果。结果显示,接受Concizumab预防治疗的患者年出血率与未接受预防治疗的患者相比,减少了86%。Concizumab此前已于2023年9月在日本获批上市。
此外,根据Pharmadigger数据库,Concizumab也于2024年12月在欧盟批准上市,是该月欧盟批准的唯一一款新药。
(注:本文中的新药分别按中国、美国、欧盟三地新分子实体或生物药首次NDA/BLA来统计,一些药物首先在美国上市后首次在中国或欧盟上市时也会纳入统计)
(责任编辑:张可欣)
分享至
右键点击另存二维码!