生物医药企业应对美国贸易管制之道
- 作者:刘新宇 张运帷
- 来源:中国食品药品网
- 2021-12-29 13:59
2021年12月15日,美国彭博社称,美国方面希望将20家包含医药生物企业在内的中国实体列入实体清单(Entity list),15日当天,A股尾盘多支创新医药股大跌,跌幅超过10%。
12月15日晚间,美国总统拜登签发了一项针对参与全球非法药物贸易的外国主体实施制裁的行政命令,并将五个实体(一名个人和四家公司)列入美国海外资产控制办公室(OFAC)旗下的特别指定国民清单(SDN清单),其中包含两家中国公司,被列入原因系芬太尼药物滥用和非法药物交易。
尽管本次制裁对象系参与国际非法药物贸易相关个人及公司,与CXO上市公司及生物医药创新公司并不相关,但生物医疗领域一直以来均系美国方面重点关注的领域,该领域企业的贸易管制风险不容忽视。
生物医疗领域的美国贸易管制大事记
美国为保持其技术、科学等方面的领先地位,对中国生物医药领域的打压由来已久。近年来,其采取包括限制投资、加征301关税、将主要头部企业列入各类管制清单以及加强技术出口管制等一系列措施,对相关领域的中国企业予以限制与制裁。
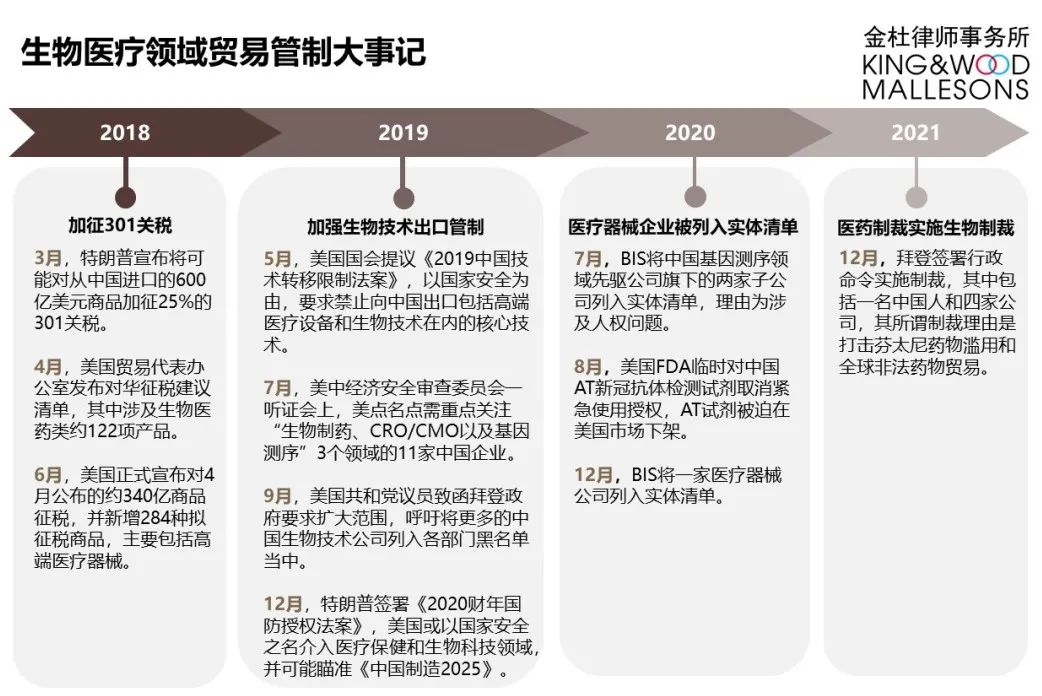
美国对生物医药领域企业的具体限制措施
生物技术
近年,中国成为生物技术研发和产业化的重要市场和利润中心。对此,美国以诸如将新兴技术与基础技术纳入到美国受控物项(含技术)的范畴等手段,不断加强对技术出口的限制。
2020年10月,美国商务部工业和安全局(BIS)对外发布了针对六大类新兴技术的管控措施,该项管控举措,在《出口管制改革法案》(ECRA)公开征求意见近两年后才予以推出,其延迟推出的原因不排除针对新兴技术本身的定义、范围等立法难点的反复纠结,亦不排除BIS为确保该类管控举措不仅可在美国落地,同时也可以被其盟友所采用的反复考量。举例而言,BIS即主管着其作为重要成员的多边组织澳大利亚集团(AG)所认定的某些两用微生物、毒素、生物设备和相关技术,从而使该等物项、技术在出口时,需要向美国商务部申请相关许可证。但在实践中,该等许可证申请很难获得批准。如此一来,美国便有效限制了生物技术类战略性物项流向境外。同时,将管控举措推向多边组织,无疑将进一步扩大管控的范围,从而使中国企业不仅从美国获取相关物项的难度加大,从其他国家获取此类物项很可能也将面临困境。
2021年10月5日,BIS在《联邦公报》上发布了一项最终规定,对可能用于制造生物武器的软件和技术实施新的控制。对此,BIS通过修改商业管制清单(CCL)增加新的出口管制分类号(ECCN)2D352的方式来实施控制。美国针对某些生物设备软件(即2D352)的新出口限制将对实验室、生命科学公司、大学和研究机构产生重大影响,并可能导致在外国投资方面的重大障碍。2021年12月16日,BIS再次假借维护美国国家安全和外界利益的事由,将中国某军事医学科学院及其下属研究机构列入实体清单。
据BIS官方统计数据显示,美国先进生物技术出口至中国的比重在2019至2020年期间,环比大幅下跌19%,具体图示如下:
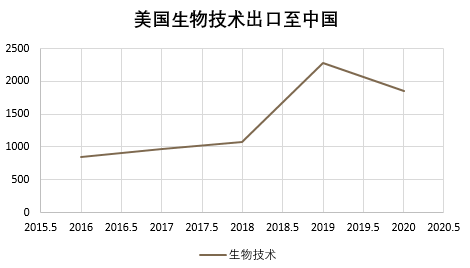
(单位:百万美元)
由此可见,美国单边管控生物技术的出口,并继续加强对新兴技术和基础技术的管控,同时推动多边机制共同加强监管,除了物项管制以外,BIS也继续落实其出口管制重要工具之实体清单,通过将中国生物技术相关企业加入实体清单的方式进一步对其予以打压。而面对生物医药行业普遍存在的并购模式,美国政府也开启了针对新兴技术的国家安全审查,通过BIS/CFIUS等各不同职能维度并在各项业务开展模式中设置审批审查机制,防止美国先进技术流入中国,以此阻碍正常的商业运作。
生物制药
中国生物制药产业起步较晚,研发基础较弱,对美国的依赖程度较高,例如当前在上游生物专用药原材料与研发设备供应两方面,仍然严重依赖从美国进口。
对此,美国仍在关键物项上施加出口管制等举措。生物制药方面,CCL规定的受控物项包含:ECCN 1C351(人类和动物的病原体及毒素)、1C353(遗传因子和转基因生物)、1C354(植物病原体)和1C991(疫苗、免疫毒素等)。同前述生物技术领域一样,上述不同ECCN管控项下的生物物项,也有着不同的管控级别和许可要求,并且多数都由于生化武器的管控原因(CB1/CB2/CB3),导致该等物项从美国出口至其他国家,需要获得BIS颁发的出口许可证,而上述生物物项基于同样生化武器管控原因,如果出口目的地是中国,那么目前的政策一律要求申请出口许可证。
其次,多数生物制药企业均拥有广泛的国内与国际业务及市场,客户、分销商及最终用户遍布全世界,而这些特点也使得生物制药行业的参与者可能面临愈发严格的管制与制裁方面的监管挑战,并成为美国执法的目标。
医疗器械设备(含研发器械)
生物制药过程中涉及的研发、检验、制造三类医疗器械设备同样严重依赖进口产品。尽管其中有些物项已实现国产化或国产进口兼有,但由于在质量功能上存在差距,目前仍存在国外垄断“卡脖子”的风险。而这类医疗器械设备,同样在美国CCL的管控之下,包括阀、泵、反应器、搅拌器、发酵罐及各式实验设备等,通常归于2B350和2B352项下,出口至中国需要申请出口许可证。
从过往10年执法案例实践来看,医疗器械领域企业受处罚的比例相对较高,2016年引人瞩目的某大型制药企业向美禁运国家伊朗等销售大量外科手术设备及药品,受到940万美元处罚;2017年,美国某超声设备供应商因涉伊朗交易,向OFAC支付50万美元处罚等。由过往执法及处罚案例可见,美国政府对医疗器械领域供应链活动的关注度极高。
生物医药领域企业面临的困境
可以看出,在无法摆脱技术受限、原料受控、先进设备受限的产业大背景下,生物医药领域的中国企业主要面临如下具体困境:
关键物项“卡脖子”问题
从物项层面而言,生物医药领域相关企业就涉美特定物项获取难度将进一步加大。虽然目前理论上可以通过出口商申请出口许可的方式获取部分涉美物项,但实践中不少战略性物项许可申请实则为特定拒绝。如特定必要物项后续无法采购,势必将造成国内企业供应链的中断甚至是断裂,进而导致随后一系列如生产停滞、合同违约等重大风险。就长期而言,即使目前可以通过许可获取的物项,随着政策形势的变化,未来也可能导致出现同类物项无法采购的现实性风险。
进一步说,如相关限制后续升级导致相关企业被美国列入实体清单,那么对清单企业而言,受限的则不仅仅是这类特定的战略性物项,而是在整个涉美依赖方面的供应链整体都可能受到更加严重的打击,即无法采购更广泛的涉美物项。与此同时,其他国家和地区在研发、制造等过程中亦可能涉及美国技术、物项等,此时其欲将产品销售给清单企业,也同样受到美国出口管制相关规定的限制。
此外,据悉美国正推进向瓦森纳安排机制提出建议,将相关技术纳入多边管制,倘若瓦森纳安排机制接受了此类建议,可以预见各成员国将收紧相关技术的出口管制政策,进而导致相关企业未来的跨境技术研发安排和布局受到更为严重的不利影响,中国企业从其他国家和地区寻找“替代产品”的难度将进一步增大。
间接获取关键物项或技术受阻
鉴于上述供应链断裂风险,有不少中国生物医药企业在难以直接获取先进物项或技术的情况下,考虑通过采取并购境外企业的方式,间接获取相关物项、技术,同时扩大客户群体,助推企业进入特定市场领域。
然而,自2018年美国《外国投资风险评估现代化法案》(FIRRMA)推出以来,FIRRMA扩大了美国外国投资委员会(CFIUS)的审查权限和“关键技术”范围。可以预见,中国企业若想通过采取并购境外企业的方式获取所需技术、物项,也将面临美国贸易和投资方面的联动阻碍。此外,根据2019年生效的《欧盟外资审查条例》,中国企业对欧盟企业的投资并购,也将受到愈发严格的外资审查。由此可见,中国生物医药企业在海外投资并购阻力明显增加。
人才交流受限
最近几年,中美之间的人才流动与技术交流面临着更多挑战。在新冠肺炎疫情尚未暴发时,美国就曾以多种理由限制中美之间生物科技方面的技术、人才交流。2019年4月,美国安德森癌症中心解雇了3名华人生物科学家,其理由是3人可能“严重”违反了保密原则,向中国政府透露了重要研究成果和数据。同年5月,美国埃默里大学辞退了华裔人类遗传学家教授夫妇,其理由是该对夫妇没有充分披露来自中国的研究经费,以及他们在中国研究机构和大学的工作内容。
在疫情暴发以及后疫情时代,人才流动本就受疫情防控等因素影响而受到很大限制,加上各国更加注重保护本国生物科技成果,若再受到限制清单等限制或制裁,中美之间、中国与其他国家之间在生物医药领域的人才流动与技术交流,只会“雪上加霜”,面临更多阻力。
经济制裁风险
疫情下,生物医药企业的产品进出口更加频繁。近期,针对委内瑞拉、伊朗、朝鲜等特定制裁国家,美国OFAC在经济制裁方面规定了特定的许可豁免政策,即美国和非美国人员可根据美国制裁法律和法规的现有豁免、例外和授权,向特定受美国制裁的国家或地区提供人道主义物品,包括药品和医疗器械。与此同时,对于此类项目中可能对抗击疫情有帮助的物项,例如氧气发生器、全罩式口罩呼吸器、某些诊断医学成像设备和去污设备等,美国OFAC考虑并加快对这些许可请求的审查。
但是需注意,若是出口的生物医药产品被认定为不属于豁免范畴的,如有发展为生化武器的风险,则可能会受到制裁。实务中,医药企业在从事进出口业务的过程中时有提供超出许可的产品或服务,从而触碰美国出口管制与经济制裁红线的案例。此时,除了受到罚款以外,还可能导致其被列入SDN清单,从而出现对外交易全面受阻的情况。
美国贸易管制环境下生物医药领域企业的应对措施
全面的风险评估与动态预警
相关的中国生物医药企业应对美国出口管制及经济制裁相关法律法规的重点内容进行学习和解读,并在防患于未然的大前提下,提前委托专业人士并利用专业工具,结合企业自身经营状况进行风险评估,例如排查供应链安全,并对相关信息等进行持续、完善的搜集和动态追踪,以便提前预警。
就供应链安全而言,企业应提早熟悉生物医药产业所涉及的拟引进主要物项的受控情况,对现有的业务模式及所涉及的商品、技术、软件等进行全面梳理,并有针对性地减弱对中游研发过程中涉美管控物项的依赖,同时,针对依赖度较高的涉美关键物项,在可能的情况下有计划地适当增加部分物项的采购数量,提高库存储备底线要求,同时积极寻找并探讨供应链替代方案,以分散供应链的国别和区域风险。
此外,相关企业除需关注受限商品、受限技术,以及其最终用途、最终用户等常见注意事项之外,还需对国家和地区、人权等特定领域的话题保持敏感,通过寻求专业机构帮助,在自身风险防控上做好监管与审查,规避“可预见”风险。
药品许可交易合同的梳理审查
越来越多的中国药企广泛参与药品许可交易。交易时,相关企业通常作为被许可方引进境外上市药品,据此享有在中国境内和其他区域的对该等药品的研发、生产和商业化权利。此类交易的许可药品通常来自美国、欧盟或其他设有严格出口管制制度的国家或地区。药品出口国的出口管制政策变化可能导致药品技术无法出口至中国,导致交易的合同目的落空,相关企业可能在支付了高额的许可费之后却无法取得许可药品。
建议中国药企梳理已经签署的药品许可交易合同,审查是否已订立出口管制、经济制裁相关条款,约定如果许可药品技术因出口国法规、政策变化或难以取得批准而导致无法将其出口至中国,则境外许可方应当退还许可费并补偿被许可方的相关损失。(作者单位:金杜律师事务所)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐
-
-

生物医药企业应对美国贸易管制之道
实务中,医药企业在从事进出口业务的过程中时有提供超出许可的产品或服务,从而触碰美国出口管制与经济制裁红线的案例。此时,除了受到罚款以外,还可能导致其被列入SDN清单 2021-12-29 13:59
-
热点排行
- 双循环格局对医药行业发展的影响:双循环格局下的医药发展新机遇
- 医保专题分析报告:2019年各省医保收支分析
- 昔日巨资购进 今日尽力剥离 太安堂拟出售康爱多不超过60%股份
- 对话·医药资本圈 | 杨松:医药行业将长期向好
- 分子诊断行业深度报告:精准医疗,看PCR还是NGS?
- 医药行业深度报告:耗材带量采购背景下,医疗器械“路在何方”?
- 医药行业2021年投资策略:“双循环”背景下,“创新升级+进口替代”引领医药大时代
- PCR行业深度报告:后疫情时代,PCR行业迎投资布局新机遇期
- 2020年医药行业11月策略报告:静待创新药医保谈判落地
- 财经药点|2020年报发布完毕,43家药企营收破百亿,医疗器械表现亮眼








